|
||
|
|
||
| Главная ≫ Инфотека ≫ Разное ≫ Книги ≫ Глава пятая. Атомы. Редукция вещества / Десять великих идей науки. Как устроен наш мир // Питер Эткинз |
Глава пятая. Атомы. Редукция вещества / Десять великих идей науки. Как устроен наш мирПитер Эткинз
Глава пятая. Атомы. Редукция веществаЯ покажу те атомы, из которых природа творит все вещи… Великая идея: вещество состоит из атомовМы видели внешние проявления изменений в образовании биосферы и внутренние механизмы этих изменений в молекулярных основаниях генетики. Мы видели то, что не изменяется, энергию, и видели, в терминах энтропии, почему изменяются вещи. Теперь мы исследуем материальную основу изменений еще более детально, совершив, таким образом, переход от мастодонтов к элементам.Что сообщает наука о природе вещества, материала, из которого сделано все, доступное ощущениям? Мы изучим этот чрезвычайно важный вопрос в два этапа. На первом этапе, составляющем предмет настоящей главы, мы исследуем вопрос, который окажется лежащим на поверхностном уровне, хотя и не выглядит таким, и опишем появление концепции атома, этой валюты всех рассуждений в химии. Мы увидим, почему различные атомы имеют различные индивидуальности, которые мы называем их химическими свойствами. Пусть не оттолкнет вас мысль о том, что эта глава посвящена химии. Химия является мостом между постигаемым миром веществ и воображаемым миром атомов, и несмотря на зачастую ужасные воспоминания о столкновениях с этим предметом в школе, он способен глубоко очаровывать и просвещать, даже если его скорее вертят в руках (как здесь), чем разжевывают. Моя цель — ввести сюда немного химии, чтобы ваши глаза увидели мир вокруг вас, и ваше восхищение им стало глубже. Затем, в следующей главе, мы оставим поверхностный взгляд на атомы и погрузимся в самые глубины того понятия, которое мы именуем материей. Тогда мы приблизимся к пониманию того, чем материя является на самом деле, и сделаем это таким способом, который мог бы удовлетворить даже древних греков. Греки много думали о материи и предложили так много различных гипотез о ее природе, что по крайней мере одна из них, вполне вероятно, могла оказаться правильной. Некоторые из их предположений были совершенно ложны, но демонстрировали достойный одобрения дух исследования. Так, Фалес из Милета (около 500 до н.э.), считающийся в народном воображении отцом философии, найдя высоко в горах ископаемые морские раковины, незадолго до своей кончины внезапно пришел к заключению, что все сделано из воды. Тысячу лет спустя этот взгляд нашел свое место в Коране: Мы… сделали из воды всякую вещь живую. Неужели они не уверуют?[20]Величие этого источника в глазах некоторых придает такому взгляду авторитетность даже сегодня. Однако греки продвигались в своих поисках понимания, считая, что одной сущности недостаточно для объяснения многообразия сущностей мира. Так, Гераклит из Эфеса (приблизительно 540-475 до н.э.), развивая идею Фалеса, заключил, что необходим агент изменений, и добавил в котел бытия огонь. Вскоре Эмпедокл из Сицилии (приблизительно 492-432 до н.э.), считая, что твердость трудно образовать только из воды, воздуха и огня, усовершенствовал эту первосмесь еще больше, добавив к ней землю, и предположив, а возможно и веря, что все может быть построено из воздуха, земли, огня и воды (рис. 5.1). Аристотель (384-322 до н.э.) был почти полностью согласен с эмпедокловой редукцией мира к четырем элементам, возражая только, что подлунный мир Земли, это театр перемен и распада, совершенно отличен от вечной небесной сферы, и что эмпедокловы элементы приложимы к первому, но недостаточны для понимания последней. Для вневременной, совершенной небесной сферы Аристотель считал обязательным пятый основной элемент, квинтэссенцию.
Все это было, конечно, совершенно неверно, так как ни одна из этих сущностей не является элементарной, за исключением, возможно, гипотетической, экспериментально ненаблюдаемой и, как мы знаем, не существующей квинтэссенции на небесах. Но формулирование и разработка концепции о том, что сложное возникает из простого, были фундаментально важным понятийным шагом, и этот подход до сих пор лежит в сердцевине современной науки. Предположение о существовании элементов, пусть даже и неправильных элементов, подняло вопрос, который находится в центре внимания настоящей главы: является ли вещество непрерывным или дискретным. Другими словами, можно ли делить элементы ad infinitum на все более малые кусочки, или они дискретны, и в этом случае деление приведет нас к далее неделимому, к атомам? У греков спекуляции процветали и обладали той свободой, которую дает лишь отсутствие экспериментальных данных, поэтому обе идеи нашли своих сторонников. То, что одна из этих идей, атомистическая точка зрения, оказалась верной, не заставляет нас непременно восхищаться ее приверженцами, поскольку они поддерживали эту версию, исходя из прихотливого умозрения и философских пристрастий, которые в наши дни не считаются особо надежными составляющими научного метода при поиске истины. Мы можем проследить линию удачных спекуляций до Левкиппа из Милета (не ранее 450-420 до н.э.), который представлял себе материю гранулированной, состоящей из атомов, которые ставят предел делимости. Только если существует конец возможности деления, утверждал Левкипп, материя может быть вечной, ибо в противном случае все давным-давно распылилось бы в ничто. Однако его точка зрения на атомы была далека от той, которую мы теперь считаем ортодоксальной. Так, он представлял себе, что атомы имеют большой диапазон форм и размеров и что почти все различные вещества сделаны из различных атомов. Эти взгляды развил и назвал умозрительные неделимые сущности атомами ученик Левкиппа, «смеющийся философ» Демокрит из Абдеры (приблизительно 350-322 до н. э.). Демокрит придерживался точки зрения, что существуют атомы молока и атомы угля, атомы костей и атомы воды. Его воображение текло, не стесненное экспериментом, и он считал существующими атомы дыхания, звука и души. Атомы души он считал особенно красивыми, как и приличествует душе; среди атомов цвета атомы белого были гладкими и округлыми, как бы интерпретирующими сам этот цвет. Эти мысли были частью системы верований эпикурейцев, последователей Эпикура (341-270 до н.э.), который использовал их для атак на суеверия, утверждая, что, поскольку все, включая богов, сделано из атомов, то даже боги — для Эпикура боги были обаятельно безучастными, они были существами, жившими в свое удовольствие, образцами удовлетворенности и высокомерия, не утруждавшими себя вмешательством в ничтожные человеческие дела — были субъектами законов природы. Эпикурейский взгляд на мир, прихотливое сочетание гедонизма и атомизма, рассматривал ощущения как основу знания и считал их впечатлениями души, происходящими от образов, передаваемых изящными фильмами, составленными из атомов, которые испускают ощущаемые объекты. Атомический взгляд на структуру материи и ощущения предстал перед восприимчивой и утомленной тиранами и богами римской публикой в дидактической, написанной искусными гекзаметрами, эпической поэме Тита Лукреция Кара (около 95-55) De rerum natura (О природе вещей), которую можно рассматривать как первое руководство по физической химии. Этот текст считался утраченным вплоть до пятнадцатого века, но после его нового обретения он подвигнул умы многих современников этого события опять обратиться к атомизму. Платон и его ученик Аристотель были ярыми противниками атомизма, и их авторитетный, хотя и пагубно влияющий взгляд на мир доминировал на всем протяжении Средних веков, ни в малейшей степени не считаясь с сильным течением материализма и атеизма эпикурейского толка. Аристотель полагал, что атомизм, который он считал чистым вымыслом и поэтому — не в пример его собственным чистым вымыслам — заслуживающим лишь презрения, не способен дать объяснение богатейшему узору чувственного опыта, который характеризует реальный мир. Кроме того, он наложил анафему на пустоту, которая была бы необходима, если бы атомы должны были двигаться. Ведь в пустоте, как он думал, не может поддерживаться движение, ибо в пустоте нет тягловой силы, а движения без тягловой силы не бывает (см. главу 3). Сила авторитета Аристотеля была такова, что его взгляды, с небольшими дополнительными вкраплениями, формировали мировосприятие людей целых два тысячелетия. Они поддерживали алхимиков в их ложно направленных и по большей части бесплодных усилиях, а его взгляды на движение душили также и физику. И так же, как в семнадцатом веке, мир пробудился и осознал пустоту аристотелевской физики из кресла, людям постепенно стало приходить в голову, что его химия из кресла тоже пуста. Однако, хотя мы можем осмеивать Аристотеля с наших позиций, лежащих далеко вниз по течению от его интеллектуального наследия и отделенных от его образа мыслей несколькими научными революциями, мы не станем переадресовывать наши похвалы эпикурейцам, несмотря на то, что, как кажется на первый взгляд, они были ближе к истине. Эпикурейцы тоже были ограничены своими креслами, и их атомизм был столь же произвольной спекуляцией, как и антиатомизм Аристотеля. Все ранние постулаты об атомах были чистыми догадками: это была спекулятивная философия, а не наука. Науке потребовалось больше времени, чтобы прийти к пониманию природы вещества, чем к пониманию движения вещества. Сама по себе природа материи оказалась более неуловимой, чем движение материи в пространстве, поскольку, хотя можно без труда прикрепить числа к положениям в пространстве и времени и приколоть таким образом динамику к лацкану физики, далеко не ясно, как числа можно прикрепить к веществу. В самом деле, а приложимы ли числа вообще к свойствам, которые обычно называют химическими? Не суждено ли природе материи навсегда остаться лишь материей для анекдотов и спекуляций? Ключом к проблеме оказался баланс (рис. 5.2). В руках Антуана Лорана де Лавуазье (1743-94), который широко известен как отец современной химии и «носитель духа счетоводства, поднявшийся до гениальности», химические весы превратились в скальпель, который стало возможно употребить для глубокого проникновения в тайну вещества. Тщательная и вдумчивая проработка дала возможность употребить весы для прикрепления чисел к веществу и ввести химические реакции в царство арифметики.
В частности, появилась возможность использовать весы для определения масс веществ, участвующих в реакции. В результате на основе этих данных начали появляться модели, а модели, как мы уже видели, являются живой кровью науки и зародышами теорий. Модель масс для соединяющихся элементов стала желудем на ветке дуба атомической гипотезы Дальтона. Джон Дальтон (1766-1844), мрачный, не различавший цвета сын ткача-квакера, в двенадцать лет школьный учитель и педантичный наблюдатель погоды, не имел других развлечений, кроме боулинга по вечерам каждый четверг. Возможно, подсознательная память о шарах боулинга и привела его к теории, которую он впервые представил на лекции в Королевском обществе в декабре 1803 г. и опубликовал в 1807 г. Его гипотеза заключалась в том, что вещество состоит из атомов, которые не могут быть сотворенными или разрушенными, что все атомы данного элемента идентичны и что в химических реакциях атомы просто меняют партнеров. Главной его концепцией было то, что каждый атом имеет характерную массу и что химические весы являются поэтому счетчиком изменений массы, происходящих при смене атомами своих партнеров. Это был шаг, называемый философами науки трансдукцией, в котором концепция на микроскопическом уровне связана с наблюдаемым макроскопическим свойством. Большая часть современных физики и химии является результатом трансдукции, так что наблюдаемое интерпретируется в терминах воображаемого, а определенные измерения, сделанные в масштабе, соизмеримом с человеком, интерпретируется в терминах сущностей, которые в миллиарды раз меньше. Дальтон на самом деле пошел несколько дальше, чем теперь считается удобным помнить. Он полагал, что атомы различных элементов окружены различными количествами теплорода, гипотетической (и впоследствии отвергнутой) невесомой жидкости, которую мы ощущаем как тепло (глава 3). Он предполагал, что атомы газообразных элементов имеют самую толстую оболочку из теплорода, которая позволяет им передвигаться почти свободно. Атомы твердых тел имеют самые тонкие оболочки, и это означает, что они остаются на местах. Эти приводящие в легкое замешательство умопомрачительные следствия атомической гипотезы были прочно забыты. Используя весы, Дальтон сумел составить список масс своих атомов, по отношению к принятой за 1 массе атома водорода, легчайшего из элементов. Он назвал эти относительные массы атомов атомными весами, и этим названием все еще пользуются. Его эксперименты были грубыми, а его интерпретация этих экспериментов зависела от предположений о том, как много атомов одного элемента соединены с атомами другого, и тут его догадки часто оказывались неверными (рис. 5.3). Так, используя в качестве гида простоту, он предположил, что вода состоит из одного атома кислорода и одного атома водорода, и заключил, что атомный вес кислорода равен 7 (на самом деле, исходя из его предположения, точные измерения дали бы 8); мы знаем, что в действительности вода состоит из двух атомов водорода и одного атома кислорода, поэтому истинный атомный вес кислорода равен 16, т.е. атом кислорода в 16 раз тяжелее атома водорода. Тем не менее это самая ранняя версия трансдукции во всей ее славе, когда лабораторные наблюдения выражают свойства невидимого.
В отличие от древнегреческих умозрений об атомной природе вещества, теория Дальтона была научной. В ней не было никаких ленивых, или даже энергичных, умствований; это были наблюдения, основанные на эксперименте и соединенные с рациональностью. Не все, однако, приняли ее в качестве характеристики реальности. Многие годы среди ученых бытовала точка зрения, что атомы — это вычислительная фикция, полезные символы для совершения расчетов, в том числе расчета масс, но безо всякого реального смысла. Большинство возражений отпало около 1858 г., когда итальянский химик и революционер Станислао Канниццаро (1826-1910) опубликовал гораздо более точный список атомных весов известных элементов, но даже в конце девятнадцатого столетия некоторые крайние консерваторы отказывались прикрепить свое знамя к атомистическому флагштоку. Современная техника наблюдения продрались сквозь лес возражений, которые пришлось преодолевать Дальтону и его последователям. Сегодня мы имеем возможность видеть атомы как отдельные капли материи (рис. 5.4). и больше нет никаких сомнений в их существовании. Конечно, некоторые социологи науки могут размахивать своими сверхпессимистическими флагами и утверждать, что прибор, использованный для получения этих изображений, является скорее социальной конструкцией, и спроектирован он так, чтобы выражать современную парадигму; однако ученым виднее.
Итак, что же такое атомы? На что они похожи? Как они сделаны? Дальтон, как и греки, предположил, что атомы есть предел делимости; никакой атом нельзя разрезать на куски, никакой атом не имеет более мелких составляющих. Но если бы это было так, было бы трудно понять, как можно объяснить богатый спектр свойств элементов, поскольку разнообразие свойств проистекает из богатства соединений. То, что атомы на самом деле имеют внутреннюю структуру, впервые продемонстрировал Дж. Дж. Томсон (1856-1940), который в 1897 г. показал, что из атомов могут вылетать электроны. Он объявил о своем открытии в Королевском обществе 30 апреля 1897 г. Электроны были первыми из идентифицированных субатомных частиц, частиц, меньших, чем атом, а работа Томсона в Кавендишской лаборатории в Кембридже показала, что они являются универсальной составляющей вещества и что поэтому атомы действительно обладают внутренней структурой. В это время (в самом конце девятнадцатого века) случилось великое замешательство относительно того, как могли быть организованы электроны. Кое-кто подозревал, что один атом может состоять из тысяч электронов. Проблема осложнялась отсутствием какой-либо информации о существовании частиц с положительным зарядом, компенсирующим отрицательный электрический заряд электронов. Эту проблему отправила на покой работа новозеландца Эрнеста Резерфорда (лорд Резерфорд Нельсон, 1871-1937), который, находясь в Манчестере, наткнулся в 1910 г. на существование ядра, мельчайшего пятнышка положительно заряженного вещества, лежащего в центре атома, которое, будучи много меньше самого атома, ответственно фактически за всю его массу. Здесь будет уместно дать представление о размерах и массах различных объектов, которые к этому времени появились на сцене. Типичный атом имеет диаметр около 3 миллиардных метра (3×10−9 м, 3 нанометра, 3 нм). Так, миллион таких атомов, выложенный в ряд, протянется на 3 мм в длину. Теперь вы, может быть, получили возможность вообразить размер этих атомов. Легче представить себе то же тире увеличенным примерно до длины 3 километра, тогда каждый атом занял бы 3 миллиметра, как икринка рыбки «морской воробей». Как вы, вероятно, догадываетесь, атомы являются довольно большими: им приходится быть такими, потому что в них много чего набито. Большинство людей думает, что атомы очень маленькие, но это лишь потому, что мы сами очень большие: нам приходится быть такими, потому что в нас много чего набито. Когда вы начинаете думать, что атомы большие, они становятся гораздо менее устрашающими. Было бы полезно в воображении надувать атом до тех пор, пока он не достигнет примерно метра в поперечнике. Ядро атома тоже велико, поскольку в него тоже набито много вещей. Большинство людей думает, что оно очень, очень маленькое; но это не очень хорошие мысли, потому что такие мысли мешают уму вообразить, на что оно похоже. Некоторые ученые могли бы подумать, что такая помеха очень хорошая вещь, поскольку перенесение макроскопических идей на сущности столь малые, как атомы, не говоря уж о ядре, чревато опасностью, ибо знакомые понятия просто не приложимы к столь малым объектам (как мы с лихвой убедимся в главе 7, посвященной квантовой теории). Пусть так, но давайте по крайней мере попробуем вообразить себе диаметр ядра. Эксперименты показывают, что диаметр ядра составляет примерно одну десятитысячную диаметра атома. Поэтому, если мы подумаем об атоме, как о шаре примерно с метровым диаметром, его ядро будет пятнышком с диаметром лишь в одну десятую миллиметра. Поэтому для таких увесистых творений, как мы, ядро действительно очень мало; даже для воспринимающего существа размером с атом оно казалось бы довольно маленьким, хотя и различимым. Но для физиков-ядерщиков, которым необходимо понимать устройство ядер, оно довольно большое. Как мы отметили, ядро является большим, потому что в него так много набито. В нем располагается положительный заряд атома, который компенсирует отрицательный заряд окружающих его электронов. Здесь также располагается почти вся масса атома, так как только около 0,1 процента его общей массы находится в электронах. Когда вы поднимаете тяжелый объект, вы в действительности поднимаете ядра. Если бы атомы вашего тела могли бы лишиться своих ядер, вы весили бы всего около 20 грамм. Другая, менее известная черта ядер состоит в том, что многие из них вращаются вокруг своей оси, хотя некоторые и не вращаются. Ядра водорода и азота вращаются, ядра углерода и кислорода нет. Вращение ядра не может быть изменено, это, подобно электрическому заряду, внутреннее свойство, и каждому ядру водорода суждено вращаться вечно с одной и той же неизменной скоростью. В начале двадцатого века стало ясно, что электрон был не первой субатомной частицей, которая была открыта. Самая первая была известна, но не опознавалась в этом качестве, уже более века. Ядро атома водорода, простейшего из всех атомов, состоит из единственной субатомной частицы, протона. Эта частица является сущностью, ответственной за свойства кислот, и когда вы ощущаете кислый вкус лимонного сока, на самом деле ваш язык щекочут протоны. К сожалению, мы не можем здесь исследовать это явление или выяснять, почему язык является хорошим детектором по крайней мере для элементарной частицы одного типа. Протон представляет собой тяжелую частицу с положительным зарядом, равным и противоположным заряду электрона, и с массой примерно в тысячу раз большей массы электрона. Атом водорода состоит из одного протона и присоединенного к нему электрона: положительный заряд ядра компенсируется отрицательным зарядом электрона. Следующий простейший элемент, гелий, имеет ядро, построенное из двух протонов, поэтому у него два присоединенных электрона. Число протонов в ядре атома называется атомным номером элемента, так что атомный номер водорода равен 1, атомный номер гелия равен 2, и так далее. Из того факта, что атом электрически нейтрален, а такими являются все атомы, следует, что число присутствующих в нем электронов равно атомному числу, поскольку полный положительный заряд ядра компенсируется полным отрицательным зарядом присоединенных электронов. Осознание того, что ядру элемента можно приписать номер и что этот номер можно интерпретировать в терминах состава ядра, означает, что можно наконец провести перекличку элементов. Теперь пропущенный элемент, можно идентифицировать, узнав, был ли обнаружен элемент именно с таким атомным номером, а размышления о том, существует ли какой-нибудь элемент между двумя другими, можно прекратить, если их атомные номера являются соседними. Атомные номера стало возможно определять благодаря технике, разработанной Генри Моусли (1887-1915) незадолго до его призыва на военную службу для того лишь, чтобы под Галлиполи его настигла пуля снайпера. Как написал Уилфред Оуэн перед встречей со своей собственной пулей однажды вечером на исходе той же войны: Отвага была моей, и с ней тайна,Это и была власть, основанная на мудрости, сорвавшая покров тайны, и теперь мы знаем весь список элементов, знаем о ядре и числе электронов, присутствующих в каждом атоме. Точное расположение электронов вокруг ядра все еще оставалось проблемой. На этом этапе обсуждения важно понять то, что атом представляет собой почти полностью пустое пространство. Вся его масса, как мы видели, сосредоточена в мельчайшем центральном ядре, а окружающее ядро пространство, вплоть до расстояния, составляющего примерно 10 тысяч диаметров ядра, занято горстью электронов — например, шестью, в случае углерода. Ваше тело представляет собой это почти пустое пространство, хотя, так или иначе, вы кажетесь материальным. Вы являетесь пустотой в реальном, а не ироническом смысле, думаете почти пустыми мозгами, одеваетесь в пустоту, сидите на пустоте и поддерживаетесь ею. Чтобы вообразить пустоту атома, представьте, что вы стоите на ядре размером с Землю, глядя в ясное звездное ночное небо. Пустота пространства, которое вы видите вокруг себя, не будет отличаться от пустоты атома внутри вас. Однако эта пустота вне ядра является средоточием индивидуальности элемента. В то время как ядро является пассивным наблюдателем, просто отвечающим за размещение вокруг себя дополняющих его электронов центром контроля, дымок электронов, занимающих почти пустое пространство, является участником химических реакций. Ученые не смогли устоять перед искушением высказать предположение, что электроны по отношению к ядру подобны планетам по отношению к звезде или Луне по отношению к Земле, и этот образ все еще столь могуществен, что было бы лучше, если бы я не упоминал о нем. «Сатурнианская» планетарная модель атома была предложена японским физиком Хантаро Нагаока (1865-1950) в 1904 г. и стала естественно предполагаемой моделью после того, как несколько лет спустя Резерфорд открыл ядро. Планетарную модель, которую теперь представляли в виде планет, вращающихся вокруг звезды, а не в виде колец вокруг Сатурна, как предлагал Нагаока, призвали к жизни в 1912 г., когда Нильс Бор использовал раннюю версию квантовой теории для описания движения одиночного электрона в атоме водорода и для своего успешного расчета спектра излучения атома. Можно лишь позавидовать, представляя себе всю глубину восторга Бора, когда он обнаружил, что его расчеты почти точно согласуются с наблюдениями. Но даже это — планетарная модель и, как казалось, подтверждающий ее талантливый расчет Бора — было неверно. Отсюда можно извлечь два урока для науки и жизни. Во-первых, мы не можем полагаться на перенесение, без основательной оглядки, знакомых закономерностей макромира в доселе неизвестный нам микромир. Под поверхностью реальности живут драконы. Во-вторых, даже количественное согласие может, при некоторых обстоятельствах, быть недостоверным свидетельством истины. Этими некоторыми обстоятельствами, сделавшими свидетельство недостоверным, в данном примере была «красота» — термин, со смыслом которого мы встретимся в следующей главе, а пока это лишь забавная и загадочная — характеристика электрического притяжения электрона к ядру. Вы должны выбросить из вашего сознания, а еще лучше из вашего бессознательного, образ планет, вращающихся вокруг центрального ядра: он просто неверен. Это ложная модель атома, это научная фикция, мертвая, отброшенная модель. Чтобы увидеть ее ошибочность, надо понять, что электроны не являются частицами в привычном смысле, но имеют внутренние свойства, подобные волновым. Этот двойственный характер, лежащий в сердце квантовой теории и появляющийся на сцене в главе 7, устраняет понятие траектории, в данном случае орбитального пути планетарного электрона вокруг центрального звездоподобного ядра, и делает абсолютно неприемлемым образ электрона в виде частицы на орбите. В главе 7 мы увидим, как Эрвин Шредингер (1887-1961) создал уравнение, решения которого рассказывают нам о поведении электронов. Все, что нам необходимо знать на этом этапе, это несколько следствий из него, касающихся атомов. То, что на сегодняшний день считается достаточно точной структурой атома водорода — к другим атомам мы придем позднее, — было одним из первых результатов использования уравнения Шредингера. В серии из четырех знаменитых работ (первая в трех частях), опубликованной в 1926 г., написанной во время каникул с любовницей и названной им «поздним эротическим взрывом», Шредингер решил свое уравнение для электрона в атоме водорода и получил из совершенно других предпосылок то же выражение для его энергии, которое до этого обнаружил Бор. Чтобы понять результат вычислений Шредингера, мы должны знать, что решения его уравнения предсказывают вероятность того, что электрон будет обнаружен в некоторой точке пространства, а не точное положение электрона в любой момент, как в классической физике. Эти решения называются атомными орбиталями. В таком названии выражен намек на планетарный электрон на орбите, но без строгого смысла этой классической концепции, здесь неприменимой. Рисунок 5.5 показывает форму обладающей самой низкой энергией атомной орбитали в атоме водорода, орбитали электрона в нормальном (основном) состоянии атома. Иллюстрация изображает вероятность обнаружения электрона в разных участках области с помощью плотности тени в них. Как можно видеть, благодаря тому, что облако является более плотным вблизи ядра, следует считать, что электрон «роится» вокруг и вблизи ядра, как осы вокруг вазы с вареньем, и с наибольшей вероятностью находится у самого ядра. Если бы вы мысленно помещали маленький полый шар в разных местах атома, вы обнаруживали бы электрон внутри шара чаще, когда шар располагается у ядра. Облако вероятности сферически симметрично (предпочтительные направления отсутствуют), поэтому мы можем также представить орбиталь сферической поверхностью, которая охватывает большую часть облака. Однако не следует думать, что орбиталь имеет резкий край: как показывает изображение на рисунке, вероятность обнаружить электрон в определенной точке постепенно стремится к нулю и — по крайней мере в принципе — достигает нуля лишь на бесконечном удалении от атома.
С этой точки зрения все атомы бесконечно велики, что находится в резком противоречии со взглядом на атомы, как на очень маленькие. Практически, конечно, вероятность нахождения электрона далеко от ядра (больше, чем на расстоянии в несколько сот триллионных метра) пренебрежимо мала. Лучше представлять себе атом водорода с электроном, находящимся в ограниченной области пространства очень близкой к ядру (в области с радиусом около 100 триллионных метров, 100 пикометров, 100 пм). Эта сферическая орбиталь с низшим уровнем энергии называется s-орбиталью. Было бы приятно думать, и в любом случае это полезное мнемоническое правило, что s означает сферичность; но на самом деле это название создано по техническим причинам, связанным с шириной линий в спектре атома водорода. Одна из особенностей, которая станет яснее, когда мы больше узнаем о квантовой теории, но о которой нам необходимо знать уже на этой стадии, состоит в том, что из факта сферической симметричности орбитали, изображенной на иллюстрации, следует, что электрон, который она описывает, имеет нулевой момент импульса, момент количества движения вокруг ядра. Мы встретили момент импульса в главе 3, где видели, что он подобен импульсу, но связан с движением по кругу, а не по прямой линии. Все, о чем нам надо знать на этом этапе, это о волновом свойстве орбитали, заключающемся в том, что о моменте импульса можно судить по тому, как быстро меняется плотность тени, когда мы путешествуем вокруг ядра. Этот факт может показаться лишь незначительной технической деталью, однако вскоре мы убедимся, что он составляет основу великолепия мира. Когда Шредингер решил свое уравнение для атома водорода, он обнаружил, что существует много других атомных орбиталей, каждая из которых соответствует более высокой энергии, чем энергия основного состояния. В качестве аналогии можно привести колебания сферы с обертонами собственной частоты, соответствующими состояниям с более высокой энергией. Электрон может подняться на эти орбиты, если сообщить ему достаточную энергию, например, с помощью вспышки молнии электрического разряда или если он поглотит энергию биения фотонов, которые мы называем вспышкой света. У этих орбиталей с более высокой энергией есть несколько характеристик, о которых нам следует знать. Во-первых, имеется целая серия s-орбиталей, каждая из которых является сферической, но с различными расстояниями от ядра: они образуют серию концентрических оболочек, подобную русской матрешке, с ядром в центре. Ни в одной из этих s-орбиталей электрон не имеет момента импульса, поэтому его можно обнаружить у самого ядра. И снова, не дайте одурачить себя, думая, что все это лишь педантичные академические детали: на таких деталях выстроены города и огромные индустрии. Существуют также решения, не обладающие сферической симметрией, в которых облака электронной вероятности сконцентрированы в областях, находящихся в разных местах по отношению к ядру, а не распределены однородно вокруг него. Нам необходимо знать о трех типах орбиталей, показанных на рис. 5.6. Орбитали, в которых вероятность собрана в две области, называются p-орбиталями, орбитали с четырьмя областями называются d-орбиталями, а орбитали с шестью областями называются f-орбиталями. Благодаря тому, что плотность тени, изображающая вероятность нахождения электрона в данном месте, меняется, когда мы, по пути измеряя ее, движемся по кругу вокруг ядра, p-, d- и f-орбитали соответствуют состоянию с ненулевым моментом импульса электрона, который они описывают, причем d-орбитали соответствуют более высокому моменту импульса, чем p-орбитали, а еще более искривленные f-орбитали соответствуют еще более высокому моменту импульса. Момент импульса является источником центробежной силы, которая отбрасывает электрон от ядра. Есть еще один незначительный технический момент, который скоро приобретет огромное значение: в результате такого центробежного эффекта в любой из этих орбиталей никогда нельзя обнаружить электрон возле самого ядра.
Нам необходимо узнать еще два свойства решений, которые Шредингер получил для своего уравнения. (Я прошу прощения за эту прелюдию, но вскоре она покажется весьма уместной.) Во-первых, посмотрим на энергетическую схему, изображенную на рис. 5.7. Мы видим, что с возрастанием энергии все большие группы орбиталей становятся допустимыми, потому что чем выше частоты и чем более искривлены пути возможных колебаний сферы, тем серьезнее может искажаться ее форма. При самой низкой энергии допустима только одна орбиталь, s-орбиталь на рис. 5.5. На следующем уровне допустимы одна s-орбиталь и три p-орбитали. На следующем, еще более высоком, уровне имеются одна s-орбиталь, три p-орбитали, 5 d-орбиталей и так далее. В этой схеме нет ничего магического, это просто схема решений уравнения Шредингера для атома водорода. Группы энергетических уровней называются электронными оболочками, потому что орбитали, принадлежащие к ним, образуют концентрические распределения вероятностей расположения электрона, более или менее подобные слоям в луковице. И последняя (да!) важная вещь это то, что орбитали водорода в каждой оболочке имеют в точности одну и ту же энергию. Это очень замечательное свойство и, как можно проследить, именно «красивый» характер взаимодействия между электроном и ядром привел к тому, что концептуально ошибочные вычисления Бора оказались количественно верными.
Теперь я проведу вас от атома водорода сквозь строй атомов других элементов. Нам известен порядок, в котором следует обсуждать эти элементы, поскольку мы знаем их атомные номера и, следовательно, число электронов, которые должны присутствовать в каждом случае. Например, если атомный номер элемента равен 15 (это номер фосфора), то его ядро имеет пятнадцать единиц положительного заряда, и, для достижения электрической нейтральности, каждый атом должен иметь пятнадцать электронов. Основная идея заключается в том, что, с небольшими видоизменениями, которые мы скоро узнаем, электроны этих атомов будут описываться орбиталями и энергиями, подобными тем, которые Шредингер нашел для водорода. Но по ходу этого конструирования атомов мы обнаружим некоторые замечательные вещи. Элементом с атомным номером 2 является гелий; он имеет двойной заряд ядра и два электрона. Состояние с наименьшей энергией для обоих электронов описывается такой же s-орбиталью, как и основное состояние атома водорода. Поскольку заряд ядра здесь больше, чем у водорода, эти два электрона будут притягиваться ближе к ядру; но, так как электроны отталкиваются друг от друга (частицы с одинаковым зарядом отталкиваются друг от друга), этому всасыванию будет оказываться некоторое сопротивление. В результате атом будет несколько более компактным, чем атом водорода, но не намного меньшим. Следующим по порядку элементом, с атомным номером 3, является литий. Ядро лития имеет тройной заряд и окружено тремя электронами. Теперь возникает удивительная вещь. Эти три электрона не могут — просто не могут — занимать самую нижнюю энергетическую s-орбиталь. Есть свойство, которое мы до сих пор совершенно пропускали в нашем обсуждении, а теперь должны ввести: электрон имеет три постоянные внутренние характеристики: массу, заряд и спин. Как мы видели ранее, многие ядра вращаются, и точно так же каждый электрон во Вселенной обладает этим свойством. Для наших целей достаточно, чтобы мы представляли спин просто как классическое вращательное движение, подобное вращению планеты вокруг оси. Однако следует иметь в виду, что в данном контексте спин является чисто квантово-механическим свойством, и на самом деле его нельзя считать классическим. Например, электрон надо дважды перевернуть, чтобы он вернулся в исходное состояние! Второе квантовое свойство спина — более соответствующее стилю предыдущего обсуждения — заключается в том, что электрон (снова используя классический язык) имеет фиксированную скорость вращения, но может вращаться с этой скоростью либо по часовой стрелке, либо против часовой стрелки. Никаких промежуточных скоростей или ориентации вращения не допускается. Третье квантовое свойство спина — и у него нету никакой классической интерпретации — это принцип запрета, предложенный в 1924 г. австрийским физиком Вольфгангом Паули (1900-58) и утверждающий следующее: На одной орбитали может присутствовать не более, чем два электрона, и если два электрона имеют одну и ту же орбиталь, их спины должны быть парными.Термин «парные» означает, что если один электрон вращается по часовой стрелке, то другой вращается против часовой стрелки. Этот принцип является ключевым для понимания химии. Он также является ключевым для понимания того, что объекты являются твердыми, несмотря на то, что состоят в основном из пустоты, потому что электроны одного атома не могут находиться в области, занятой электронами другого атома. Таким образом, несмотря на то, что электроны занимают ничтожную часть области, которую мы называем «атом», другие атомы не могут проникнуть в эту область. Так, объем нашего тела и наша способность отличаться от любого другого из окружающих нас предметов обусловлена в конечном счете электронным спином. Выключите спины электронов, и все вещество — все обитатели мира, все горы, океаны и леса, все существующее — коллапсирует в однородную каплю бесформенной слизи. Спин является источниками нашей индивидуальности. Теперь мы можем завершить историю с литием. Представим себе последовательное добавление трех электронов и распределение их по орбиталям так, чтобы получить наименьший общий уровень энергии, принимая во внимание принцип запрета. Первые два электрона занимают первую s-орбиталь. Эта орбиталь теперь содержит два электрона, поэтому она полна. Поэтому третий электрон вынужден занять одну из s- или p-орбиталей следующей оболочки. Но какую орбиталь он займет, если все четыре орбитали имеют одну и ту же энергию? То, что они имеют одну и ту же энергию, не верно. Мы утверждали это для водорода, как следствие до некоего загадочного «красивого» свойства электрического взаимодействия между ядром и электроном. Когда в атоме присутствует более чем один электрон, эта «красота» (под которой мы имеем в виду весьма специальный вид симметрии) теряется, и s- и p-орбитали больше не обладают одинаковой энергией. Причины этих различий можно усмотреть в том факте, что электрон на s-орбитали может находиться непосредственно у ядра, а электрон на p-орбитали там обнаружить нельзя. Коротко говоря, электрон на второй s-орбитали может проникать в область, занятую двумя электронами первой s-орбитали, и испытывать полную силу притяжения тройного заряда ядра лития. Из-за центробежного влияния момента импульса, электрон на p-орбитали не может проникнуть так же близко к ядру и поэтому не испытывает его полной силы притяжения. В результате он будет иметь более высокую энергию (как показано на рис. 5.7). Имея в виду эту разницу энергий, теперь можно сделать вывод, что атом лития содержит два электрона на s-орбитали в первой оболочке, окруженной электроном, занимающим s-орбиталь следующего энергетического уровня. Мы можем представлять себе, что эти электроны образуют две физических концентрических оболочки, причем одна прилегает к ядру в форме сферической сердцевины, а другая, окружающая ее, подобна мякоти плода вокруг косточки (рис. 5.8).
Следующим элементом (с атомным номером 4) является бериллий с четырьмя электронами вокруг ядра. Здесь на один электрон больше, чем в литии, и этот электрон можно присоединить к последнему внешнему электрону на второй s-орбитали. Далее идет пятый элемент, бор, с атомным номером 5 и пятью электронами. Вторая s-орбиталь заполнена, поэтому пятый электрон должен попасть на одну из трех p-орбиталей. Та же ситуация сохраняется для следующих пяти элементов, поскольку имеются три p-орбитали, и на этих орбиталях можно расположить шесть электронов. Так, углерод (шесть электронов) имеет внутреннюю сердцевину из двух электронов, как у гелия, еще два электрона на окружающей ее s-орбитали и еще два электрона на p-орбиталях. Оказывается, что последним двум электронам энергетически выгоднее занимать разные p-орбитали оболочки, так как тогда они дальше располагаются и меньше отталкиваются друг от друга. Азот (семь электронов) имеет еще один электрон на p-орбитали, кислород (восемь электронов), фтор (девять электронов) и неон (десять электронов) строятся тем же способом. На этом этапе все десять p-орбиталей оболочки заполнены, и следующий электрон (в натрии, атомный номер 11) должен занять следующую, более высокую атомную орбиталь, которая является следующей s-орбиталью. Структура атома натрия подобна структуре атома лития с заполненной внутренней сердцевиной и одиночным s-электроном, образующим концентрическую внешнюю оболочку. Это чрезвычайный момент в нашем обсуждении, хотя я и оставил проблеск, осветивший местность, почти незамеченным. Мы видели, что структура атома гелия состоит из заполненной оболочки; нам также следует знать, что гелий является инертным одноатомным газом (то есть газом, состоящим из одиночных атомов в свободном движении). Далее мы пришли к восьмому элементу, неону, еще одному инертному одноатомному газу, каждый атом которого имеет заполненную оболочку электронов. Непосредственно вслед за неоном мы уловили вспышку, идущую от лития, легко вступающего в реакции металла; его атомная структура состоит из одного электрона вне заполненной сердцевины. И теперь на сцене появляется восьмой, считая от лития, элемент, натрий, еще один металл, легко вступающий в реакции. Структура атома натрия совершенно подобна структуре атома лития, с одиночным электроном вне заполненной оболочки. Мы пролили немного света на периодичность элементов, на осознание того, что вещество является не случайным набором разрозненных элементов, а семейством, содержащим члены с подобными химическими свойствами и подобными электронными структурами. Чтобы понять роль этого открытия и увидеть его в соответствующем историческом и культурном контексте, нам надо вернуться в девятнадцатое столетие, временно позабыть о структуре атомов и увидеть элементы с их внешней стороны, более близорукими и эмпирическими глазами этого века. К середине девятнадцатого столетия было известно около пяти дюжин элементов. Некоторые были известны с доисторических времен, но не рассматривались в качестве элементов. Так, железо, уголь, медь и сера были известны древним. Они являются истинными элементами в современном смысле этого слова, а не в гадательном смысле древних греков. Элементы, по словам Роберта Бойля (1627-91) в его «Скептическом химике» (1661) представляют собой некоторые примитивные и простые или совершенно несмешанные тела; которые не составлены из других тел или, говоря иначе, являющиеся ингредиентами, из которых все эти поименованные совершенно смешанные тела непосредственно составлены и на которые они в конце концов разлагаются.По менее нудному и более операциональному определению Антуана Лавуазье они представляют собой все вещества, которые мы не смогли разложить далее никаким способом.Определение Лавуазье оставляет открытой возможность того, что более напряженными усилиями можно достичь этого разложения и таким образом спихнуть вещество со стола, где расположилось братство элементов. Лавуазье составил список из тридцати трех элементов, соответствующих его определению. Восемь, конечно, пришлось выбросить, когда стало возможным использовать более строгие процедуры, а два (свет и теплород) и вовсе не относились к делу. Современное определение стоит в стороне от этих попыток нащупать химический подход, и прямолинейно определяет элементы как вещества, состоящие из атомов с одним и тем же атомным номером.Современная эпоха для элементов началась всерьез, когда Хенниг Бранд (не ранее 1669 г.) из Гамбурга открыл фосфор, первый за много веков новый элемент. Использованная им процедура была не такой, чтобы внушить его соседям или другим возможным искателям новизны любовь к нему. Он собрал пятьдесят ведер человеческой мочи, которую заставил испаряться и разлагаться, выкипячивая ее до тестообразного осадка, дал осадку перебродить и подверг нагреванию черный остаток, смешав его с песком и собирая испарения в реторту. Эта с виду магическая субстанция светилась в воздухе и поэтому была сочтена средством для борьбы со смертью или, на худой конец, для получения выгоды. Как и в процедуре Бранда, самой ранней техникой разложения соединений на составляющие было нагревание, иногда нагревание вместе с другими веществами, как, например, с углем, для извлечения железа из железной руды, а иногда только нагревание, как при оспариваемом открытии кислорода посредством нагревания окиси ртути. До индустриальной революции получение жара высокого накала было делом трудно достижимым, и одна из прометеевых процедур заключалась в краже огня у Солнца посредством мощных линз. Новое оружие свалилось в руки встряхивателей вещества с появлением гальванического элемента и возможности использовать электрический ток. Так, Хемфри Дэви (1778-1829) подключал электроды почти ко всему, что лежало в окрестностях Королевского общества, и в течение недели в октябре 1807 г. впервые получил калий с помощью электролиза расплавленного поташа (нитрата калия), а затем натрий с помощью электролиза расплавленной соды (углекислого натрия). Джон Дэви, брат Хемфри, рассказывал, что Хемфри «безумствовал и плясал от радости» вокруг своего открытия. Всего Дэви открыл шесть новых элементов (натрий, калий, кальций, магний, стронций и барий). Волна открытий, в основном обязанная своим происхождением использованию электролиза, довела к 1818 г. число элементов до пятидесяти девяти. Шведский химик Йене Берцелиус (1779-1848) сам открыл три элемента (цезий, селен и торий) и отсоединил символические обозначения элементов от чуть-чуть алхимического и неудобного для типографий стиля Дальтона, введя более практичные буквенные обозначения, используемые нами и сегодня, такие как Ce для цезия, Se для селена и Th для тория. Дальтон был чрезвычайно рассержен этим иностранным вторжением на его территорию и получил первый из своих двух ударов во время спора с коллегой о символах. В картинке-головоломке трудно увидеть рисунок, пока не подобрано достаточно много составляющих ее фрагментов. Первый рисунок, отображающий свойства вещества, начал проявляться в 1820 г., когда собирание фрагментов было завершено почти наполовину. Существовало два аспекта этой головоломки: во-первых, качественные свойства элементов, их подобия и различия, и во-вторых, возникающая количественная характеристика атомов элементов, их атомный вес. Иоганн Доберейнер (1780-1849) из Йены, необразованный, но наблюдательный сын кучера, достигший впоследствии звания профессора университета, заметил нечто весьма необычное, нечто приводящее в гармонию эти две составляющих загадки. Он заметил, что некоторые тройки химически подобных элементов имеют атомные веса, такие, что вес одного из этих элементов близок к среднему арифметическому двух других. Например, хлор, бром и йод химически подобны, а их атомные веса равны соответственно 35, 80 и 127 (среднее от 35 и 127 равно 81). Доберейнер обнаружил три таких тройки и этим призвал к жизни идею о том, что элементы, по каким-то причинам, образуют нечто вроде гобелена. Охота за организующим принципом началась. У меня нет намерения в деталях описывать историю этой охоты или воздавать должное всем действующим лицам, поскольку я больше заинтересован представить здесь результаты, чем усилия, затраченные на их получение. Но двое из участников заслуживают того, чтобы пригласить их на сцену. Джон Ньюлэндс (1837-98) имел англо-итальянское происхождение, и, подобно Канниццаро был настолько охвачен националистическим энтузиазмом, что в двадцать три года отправился на Сицилию сражаться вместе с краснорубашечниками Гарибальди. Остепенившись, он вернулся в Англию и обнаружил еще одну составляющую рисунка. Он увидел, что Доберейнер заметил только разбросанные триады, в то время как существует более систематический узор, по крайней мере для более легких элементов. А именно, он обнаружил, что если выстроить легкие элементы в порядке возрастания атомного веса, то подобия их свойств повторяются через каждые восемь элементов (газообразные элементы гелий, неон и аргон были в то время неизвестны). Не слишком благоразумно, с ретроспективной точки зрения, он уподобил эту повторяемость нотам музыкального ряда и отнес ее на счет своего «закона октав». Эта фантастическая аналогия дорого ему обошлась: над ним насмехались за столь возмутительное и заведомо произвольное предложение, а кое-кто предлагал ему расположить элементы по алфавиту или использовать какой-нибудь другой замысловатый критерий. Однако он был прав. Свойства ранних элементов действительно повторяются как ноты музыкального ряда, но отнюдь не по музыкальной причине. Как мы видели, структуры атомов у элементов действительно периодически повторяются, поскольку внутренние оболочки заполняются и схема заселения орбиталей повторяется снова. Но такое теоретическое основание находилось слишком далеко в будущем, и ничем не могло помочь в начале девятнадцатого века, когда атомы еще пребывали в концептуальном младенчестве, а электроны не были известны. Вторым участником был, конечно, Дмитрий Иванович Менделеев (1834-1907), согласно некоему источнику, младший среди детей одиннадцати, четырнадцати и семнадцати лет (триада чисел Доберейнера!), сын торговца лошадьми (Менделеев — мену делать — меняться) и матери, героически сделавшей все возможное для своего выдающегося и не по годам развитого меньшего сына. Ко времени, когда Менделеев сел писать свой предварительный главный труд по химии, Основы химии, число известных элементов достигло шестидесяти одного. Перед ним стояла проблема, как организовать материал, чтобы представить его читателю в логической, последовательной форме. Именно в этом пункте рождественская история, по-видимому, отклоняется от суровой правды. Рождественская история рассказывает о том, как Менделеев трудился многие дни, а возможно, и недели, чтобы прийти наконец к некоторой логической организации. Истощенный этими усилиями, он заснул 17 февраля 1869 г.[21] и увидел «во сне стол, на котором все элементы лежали в нужном порядке. Проснувшись, я немедленно записал их на лист бумаги» (рис. 5.9). Еще одной популярной составляющей этой истории является то, что страсть Менделеева к раскладыванию пасьянсов для коротания времени в долгих поездках привела его к мысли записать названия элементов на карточки и раскладывать пасьянсы из них. Власть этих образов и точность с которой был датирован сон оказались такими, что заставили принять все это за чистую монету. Однако все было, по-видимому, не так: свидетельства очевидцев вступают в противоречие с обеими составляющими рождественской сказки. Сновидения не было, и даже правдоподобная сказка об элементах в виде пасьянса оказывается не столько фактом, сколько украшением.
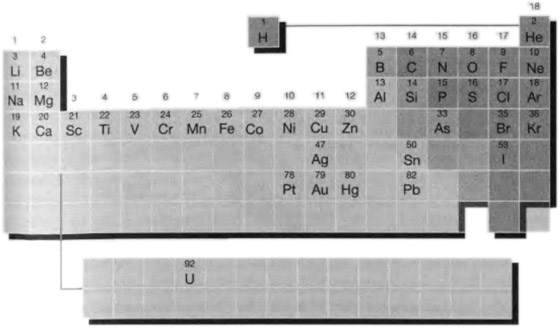
Какой бы ни была правда, фактом является то, что Менделеев представил миру таблицу, свою периодическую таблицу, которая собрала все элементы в некое подобие генеалогического дерева. Он использовал атомные веса для упорядочения элементов и обнаружил повторяемые подобия через периоды в восемь, восемь и восемнадцать элементов. Ему пришлось перекраивать таблицу то тут, то там (обычно это описывается как химический инсайт, но на самом деле больше похоже на метод, которым пользовался Прокруст по отношению к своим жертвам, не помещавшимся на его ложе). Так, порядок элементов, основанный на атомном весе, не везде согласовывался с картиной химического подобия, поэтому Менделеев проигнорировал этот порядок и избрал свой собственный. Теперь мы знаем, что эта процедура была правильной, поскольку атомный вес не является наилучшим критерием для упорядочивания элементов: элементы лучше всего упорядочивать по их атомным номерам и, по причинам, теперь полностью понятным, атомный вес не всегда дает точно тот же порядок, что и атомный номер. Кроме того, в таблице имелись приводящие в замешательство щели. Но в этом случае замешательство пошло на пользу дела, так как Менделеев был столь уверен в своей формулировке таблицы, что смог, с помощью интерполяции свойств известных элементов, предсказать свойства еще не открытых элементов в этих щелях. Так, он предсказал существование и свойства элементов, которые он назвал эка-алюминием и эка-кремнием (эка в санскрите значит один), позднее открытых во Франции под именем галлий и в Германии под именем германий соответственно. Он также делал и ошибки, предсказывая элементы, которых в действительности не существует; но, благодаря доброй воле благодарных последователей, эти ошибки были благополучно забыты. Сегодня мы знаем около 110 элементов, и щели в корпусе таблицы отсутствуют. Мы знаем это потому, что атомные номера последовательно и без пропусков пробегают ряд от 1 до 110. Имеются спорадические сообщения об открытии элементов до номера 114, но они появляются и исчезают, и номер 113 все еще не появился. Это бесполезный «академический» конец периодической таблицы, и тот факт, что он с краю немного потрепан, не имеет большого практического значения. Современная форма периодической таблицы показана на рис. 5.10. Как мы можем видеть, он повернут на 90° по сравнению с картинкой Менделеева, но основные черты его схемы легко узнать. Вертикальные колонки называются группами, а горизонтальные ряды называются периодами.
Октавы Ньюлэндса еще слышны в периодах 2 и 3, а триады Доберейнера разбросаны там и тут. Вертикальные группы содержат элементы, имеющие значительные подобия, так же как и все типы соединений, которые они образуют, и демонстрируют систематические изменения от верхнего к нижнему краю. Элементы в горизонтальных периодах демонстрируют плавное изменение при перемещении слева направо. Например, металлы оказываются в левом конце периода, а неметаллы на правом. Элементы в длинной тонкой центральной секции, такие как железо (Fe) и платина (Pt), являются переходными металлами, поскольку они представляют переход между очень реактивными металлами, такими как натрий (Na) или кальций (Ca) в левой части таблицы, и много менее реактивными металлами, такими как олово (Sn) или свинец (Pb) справа. Очень тонкая секция из двадцати восьми элементов, помещенная ниже основной части, состоит из внутренних переходных металлов. Эту полосу следовало бы, на самом деле, вставить в основную таблицу, но это сделало бы таблицу слишком длинной и тонкой для того, чтобы напечатать ее приемлемым образом. Внутренние переходные металлы все очень похожи по своим химическим свойствам и находились среди элементов, выделенных и идентифицированных в самую последнюю очередь. Самая нижняя линия, следующая за ураном (U), фактически состоит только из элементов, полученных искусственно. Периодическая таблица все еще растет. Ученые используют ускорители частиц, чтобы швырять ядра одного элемента в ядра других элементов, в надежде, что два ядра сольются и образуют ядро еще неизвестного элемента. Так был получен элемент 112 (еще не имеющий названия). Однако такие ядра очень неустойчивы, и жизнь нескольких атомов, сделанных таким способом, была весьма быстротечной. Я надеюсь, что теперь вы получили возможность понять, почему химики считают периодическую таблицу своей единственной самой главной концепцией. Она суммирует свойства элементов — изменение их физических свойств, таких как плотность, изменение свойств атомов, таких как их диаметры, и изменение их химических свойств, таких как число и тип связей, которые они образуют с другими атомами (рис. 5.11). Просто взглянув на нее, мы можем узнать, имеет ли элемент характерные свойства металла (железо), неметалла (сера) или чего-то промежуточного (кремний). Мы можем предвидеть химические свойства элемента, замечая свойства его соседей и думая о тенденциях, ожидаемых при движении вниз по группе или вдоль по периоду. Говоря коротко, периодическая таблица — это в высшей степени сжатое и полезное резюме свойств элементов, обладающее значительной предсказательной силой. Мы проделали долгий путь от первоначальной периодической таблицы, содержавшей землю, воздух, огонь и воду в обыкновенном квадрате!
Менделеев составил свою таблицу эмпирически. Он ничего не знал о структуре атомов и не мог предложить внутреннего концептуального основания для своей таблицы. У нас необходимое понимание есть. Мы теперь знаем, что периодическая таблица есть отображение ритмов заполнения энергетических уровней в атомах (рис. 5.7). Образ источника периодичности промелькнул перед нами ранее в этой главе, когда мы заметили подобие между гелием и неоном, с одной стороны, и литием и натрием, с другой, и обнаружили, что электронные структуры их атомов аналогичны: гелий и неон имеют атомы с заполненными оболочками, а в атомах лития и натрия одиночный электрон занимает s-орбиталь вне заполненных оболочек. Этот образ лежит в основании всей таблицы. Так, если переходить от атома к атому по пути возрастания атомного номера, то с каждым шагом атомный номер возрастает на единицу и потому возрастает число электронов, необходимых для компенсации заряда ядра. Каждый добавляющийся электрон занимает следующую допустимую атомную орбиталь, подчиняясь принципу запрета Паули, согласно которому одну орбиталь могут занять не более чем два электрона. Эта последовательность соответствует внешнему виду периодической таблицы. Так, у атомов элементов из групп 1 и 2 (группы, содержащие, например, натрий и магний) s-орбиталь занята. На s-орбитали может находиться до двух электронов, что соответствует двум группам в этой части таблицы: в группе 1 на орбитали находится один электрон, а в группе 2 — два электрона. В правой стороне таблицы имеется блок из шести групп: в этих элементах электроны находятся в процессе заполнения трех p-орбиталей соответствующих оболочек атомов. На этих орбиталях может находиться до шести электронов: элементы группы 13 (такие, как бор, B) имеют один такой электрон, элементы группы 14 (такие, как углерод, C) — два, и так далее, до заполненных орбиталей в группе 18, состоящей из почти полностью инертных, так называемых благородных газов. Узкая полоса в середине таблицы, переходные металлы, состоят из элементов, в которых заполняются d-орбитали соответствующих оболочек: пять d-орбиталей могут вместить до десяти электронов, что в точности соответствует десяти элементам в каждом ряду этого блока групп. Внутренние переходные элементы являются элементами заполняются f-орбитали. В каждой оболочке имеется семь f-орбиталей, что соответствует четырнадцати членам в каждом ряду этого блока. Мы совершили полный круг. Химики девятнадцатого века разглядели родственные отношения между элементами. Полный перечень родственных связей — настолько, насколько элементы уже были открыты — был создан Менделеевым к концу века. Однако его конструкция носила эмпирический характер, и понимания того, почему элементы приходятся друг другу кузенами, в то время быть не могло. Как же могло случиться, что один сорт вещества является родственным другому? На этот вопрос удалось пролить свет, когда в начале двадцатого века стала понятна структура атомов. Как только в 1920-х гг. были обнаружены ядра и правила, управляющие размещением электронов, немедленно стало ясно, что периодическая таблица является отображением решений уравнения Шредингера. Таблица представляет собой математическую картину вещества. С помощью двух простых идей — что электроны самоорганизуются так, чтобы занять наиболее низкий из возможных уровень энергии, и что на любой данной орбитали не могут находиться более двух электронов — устройство вещества стало доступным для понимания. Химия есть сердце понимания вещества, а в самом сердце химии лежит главное, о чем она повествует, — атомы. 20. Коран. 21:30. 21. По юлианскому календарю (или 1 марта по григорианскому).
ТегиПохожее
|
| Главная ≫ Инфотека ≫ Разное ≫ Книги ≫ Глава пятая. Атомы. Редукция вещества / Десять великих идей науки. Как устроен наш мир // Питер Эткинз |
|
[time: 12 ms; queries: 7]
2 Мар 2026 13:36:47 GMT+3 |


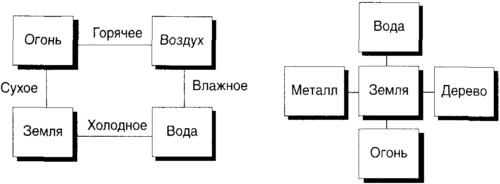



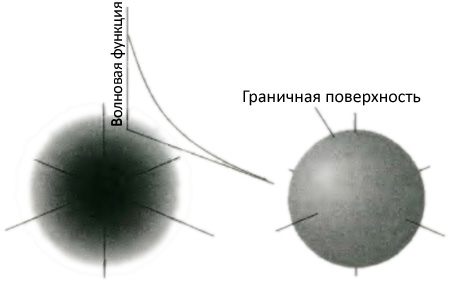
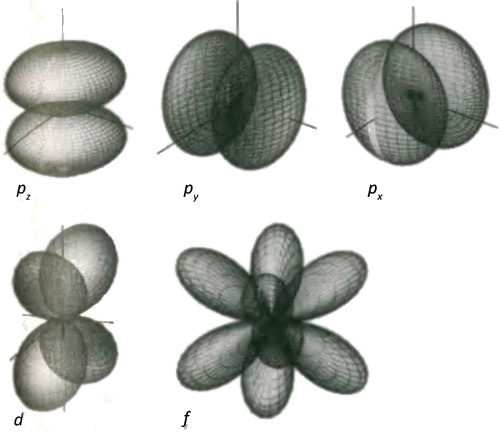
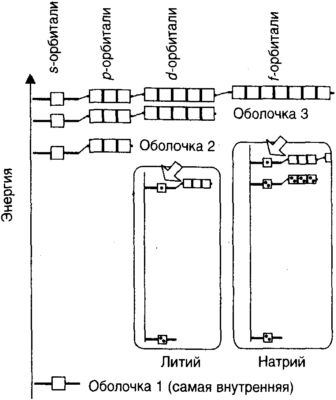
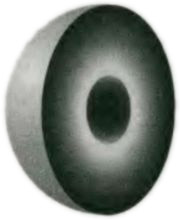 Рис. 5.8. Представление структуры атома лития. Два электрона в компактной сердцевине и один электрон во внешней оболочке.
Рис. 5.8. Представление структуры атома лития. Два электрона в компактной сердцевине и один электрон во внешней оболочке.


 Целью этой книги является строгое определение чисел, многочленов и алгебраических дробей и обоснование их свойств, уже известных из школы, а не ознакомление читателя с новыми свойствами. Поэтому читатель не найдет здесь новых для него фактов (за исключением, быть может, некоторых свойств, действительных и комплексных чисел), но узнает, как доказываются вещи, хорошо ему известные, начиная с «дважды два — четыре» и кончая правилами действий с многочленами и алгебраическими дробями. Зато читатель познакомится с рядом общих понятий, играющих в алгебре основную роль.
Целью этой книги является строгое определение чисел, многочленов и алгебраических дробей и обоснование их свойств, уже известных из школы, а не ознакомление читателя с новыми свойствами. Поэтому читатель не найдет здесь новых для него фактов (за исключением, быть может, некоторых свойств, действительных и комплексных чисел), но узнает, как доказываются вещи, хорошо ему известные, начиная с «дважды два — четыре» и кончая правилами действий с многочленами и алгебраическими дробями. Зато читатель познакомится с рядом общих понятий, играющих в алгебре основную роль. Знаменитая Теорема Гёделя о неполноте имеет две версии — синтаксическую (объявленную и доказанную самим Гёделем) и семантическую (чаще всего фигурирующую в популярных рассуждениях о великой Теореме). Семантическая версия утверждает, что какую бы систему формальных доказательств ни придумать, в языке найдутся истинные утверждения, не доказуемые в рамках предложенной системы. Таким образом, семантическая версия исходит из того, что некоторые выражения языка выражают осмысленные утверждения, являющиеся истинными или ложными. Синтаксическая версия не опирается на то, что какие бы то ни было выражения языка имеют какой-то смысл, она смотрит на выражения как на синтаксические конструкции, то есть как на цепочки символов, организованные по определённым правилам.
Знаменитая Теорема Гёделя о неполноте имеет две версии — синтаксическую (объявленную и доказанную самим Гёделем) и семантическую (чаще всего фигурирующую в популярных рассуждениях о великой Теореме). Семантическая версия утверждает, что какую бы систему формальных доказательств ни придумать, в языке найдутся истинные утверждения, не доказуемые в рамках предложенной системы. Таким образом, семантическая версия исходит из того, что некоторые выражения языка выражают осмысленные утверждения, являющиеся истинными или ложными. Синтаксическая версия не опирается на то, что какие бы то ни было выражения языка имеют какой-то смысл, она смотрит на выражения как на синтаксические конструкции, то есть как на цепочки символов, организованные по определённым правилам. Эрвин Рудольф Йозеф Александр Шредингер - австрийский физик-теоретик, лауреат Нобелевской премии по физике. Один из разработчиков квантовой механики и волновой теории материи. В 1945 г. Шредингер пишет книгу "Что такое жизнь с точки зрения физики?", оказавшую существенное влияние на развитие биофизики и молекулярной биологии. В этой книге внимательно рассмотрено несколько важнейших проблем. Основополагающим является вопрос: "Как могут физика и химия объяснить те явления в пространстве и времени, которые имеют место внутри живого организма?" Прочтение этой книги даст не только обширный теоретический материал, но и заставит задуматься над тем, что же в сущности есть жизнь?
Эрвин Рудольф Йозеф Александр Шредингер - австрийский физик-теоретик, лауреат Нобелевской премии по физике. Один из разработчиков квантовой механики и волновой теории материи. В 1945 г. Шредингер пишет книгу "Что такое жизнь с точки зрения физики?", оказавшую существенное влияние на развитие биофизики и молекулярной биологии. В этой книге внимательно рассмотрено несколько важнейших проблем. Основополагающим является вопрос: "Как могут физика и химия объяснить те явления в пространстве и времени, которые имеют место внутри живого организма?" Прочтение этой книги даст не только обширный теоретический материал, но и заставит задуматься над тем, что же в сущности есть жизнь? В отличие от метрической теории алгоритмов, дескриптивная теория не занимается измерением ресурсов (таких как время, объём памяти), затрачиваемых при применении алгоритма к его возможным исходным данным (в другой терминологии — к его входам). Её интересует лишь, возможен алгоритм для решения данной задачи или нет. Начальные понятия дескриптивной теории алгоритмов суть: конструктивный обьект, алгоритм, число шагов алгоритма, вычислимая функция, перечислимое множество, разрешимое множество, сводимость нумераций, главная вычислимая нумерация, вычислимая операция.
В отличие от метрической теории алгоритмов, дескриптивная теория не занимается измерением ресурсов (таких как время, объём памяти), затрачиваемых при применении алгоритма к его возможным исходным данным (в другой терминологии — к его входам). Её интересует лишь, возможен алгоритм для решения данной задачи или нет. Начальные понятия дескриптивной теории алгоритмов суть: конструктивный обьект, алгоритм, число шагов алгоритма, вычислимая функция, перечислимое множество, разрешимое множество, сводимость нумераций, главная вычислимая нумерация, вычислимая операция. Теорема Гёделя, наряду с открытием теории относительности, квантовой механики и ДНК, обычно рассматривается как крупнейшее научное достижение ХХ века. Почему? В чем ее суть? Каково ее значение? Эти вопросы в своей лекции раскрывает Алексей Брониславович Сосинский, математик, профессор Независимого московского университета, офицер Ордена академических пальм Французской Республики, лауреат премии Правительства РФ в области образования 2012 года. В частности, были даны несколько разных ее формулировок, описаны три подхода к ее доказательству (Колмогорова, Чейтина и самого Гёделя), и объяснено ее значение для математики, физики, компьютерной науки и философии.
Теорема Гёделя, наряду с открытием теории относительности, квантовой механики и ДНК, обычно рассматривается как крупнейшее научное достижение ХХ века. Почему? В чем ее суть? Каково ее значение? Эти вопросы в своей лекции раскрывает Алексей Брониславович Сосинский, математик, профессор Независимого московского университета, офицер Ордена академических пальм Французской Республики, лауреат премии Правительства РФ в области образования 2012 года. В частности, были даны несколько разных ее формулировок, описаны три подхода к ее доказательству (Колмогорова, Чейтина и самого Гёделя), и объяснено ее значение для математики, физики, компьютерной науки и философии. Всякая надежда на создание единой математической теории, амбициозного проекта, который был предложен математиком Давидом Гильбертом в 19 веке и продолжил существовать, поддерживаемый многими, в 20 столетии, рухнула. Основы математики были далеко не столь надежными, как того хотел бы Гильберт. А Гëдель своими теоремами ясно продемонстрировал, что любая система аксиом, какой бы обширной она ни была, уязвима для возникновения невосполнимых пробелов. Попытки же восполнить их созданием более полной системы породили бы только бóльшее количество утверждений без доказательств — так что и тут возникнет необходимость в усовершенствовании системы, и так далее до бесконечности. И случилось нечто странное: математики решили не обращать на это внимания. Они посчитали, что неполнота систем не имеет непосредственного влияния на их работу.
Всякая надежда на создание единой математической теории, амбициозного проекта, который был предложен математиком Давидом Гильбертом в 19 веке и продолжил существовать, поддерживаемый многими, в 20 столетии, рухнула. Основы математики были далеко не столь надежными, как того хотел бы Гильберт. А Гëдель своими теоремами ясно продемонстрировал, что любая система аксиом, какой бы обширной она ни была, уязвима для возникновения невосполнимых пробелов. Попытки же восполнить их созданием более полной системы породили бы только бóльшее количество утверждений без доказательств — так что и тут возникнет необходимость в усовершенствовании системы, и так далее до бесконечности. И случилось нечто странное: математики решили не обращать на это внимания. Они посчитали, что неполнота систем не имеет непосредственного влияния на их работу. В научных представлениях о происхождении жизни в последнее десятилетие происходит настоящая революция, и она далеко не завершена. К сожалению, эта информация доступна в основном только на английском языке. Цикл статей, предлагаемый вниманию читателей, отчасти восполнит этот пробел.
В научных представлениях о происхождении жизни в последнее десятилетие происходит настоящая революция, и она далеко не завершена. К сожалению, эта информация доступна в основном только на английском языке. Цикл статей, предлагаемый вниманию читателей, отчасти восполнит этот пробел.