|
||
|
|
||
| Главная ≫ Инфотека ≫ Химия ≫ Пути восстановления углекислого газа / Биогенез // Михаил Никитин |
Пути восстановления углекислого газа / БиогенезМихаил Никитин
Пути восстановления углекислого газаНикитин М.А. 
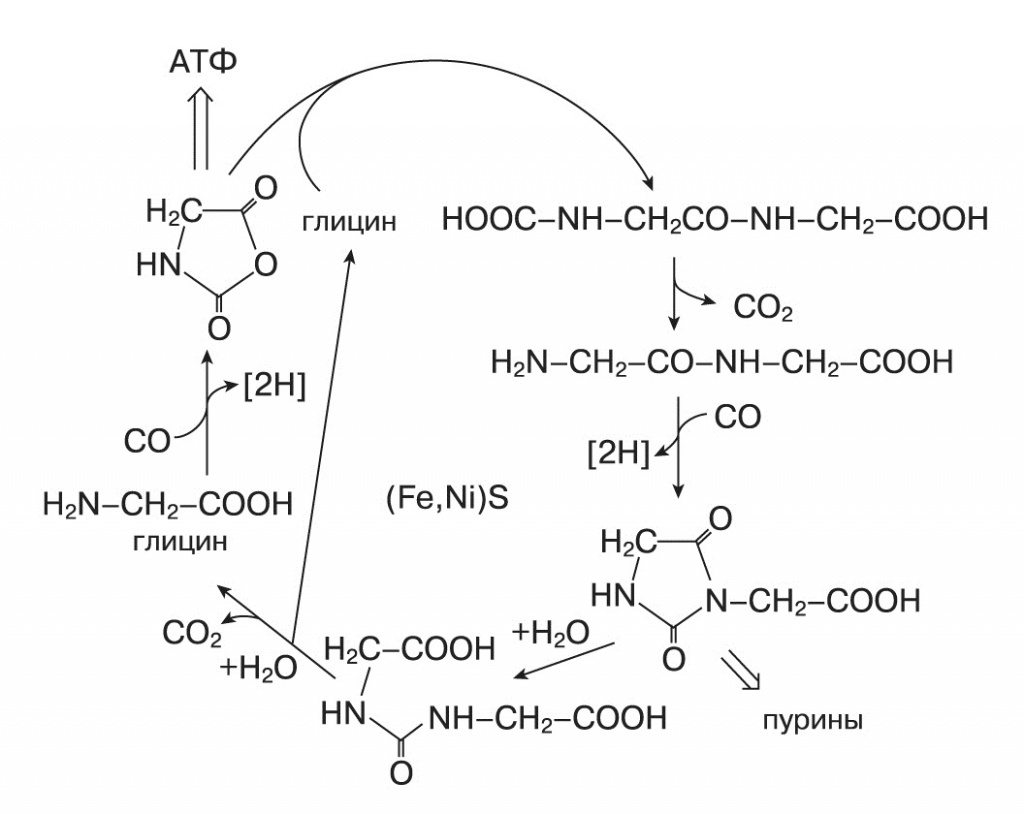
В прошлом номере мы по составу неорганических ионов в живых клетках проследили их происхождение из вод геотермальных источников и грязевых котлов. В этих же условиях среды найдены и возможные восстановители углекислого газа. Восстанавливать его нужно, чтобы затем синтезировать органические вещества, ведь скелет каждой органической молекулы, в том числе аминокислот, углеводов, липидов, составляют атомы углерода, когда-то входившие в состав CO2. Теория «железосерного мира» — первое развернутое описание, объединяющее восстановление CO2 с другими сторонами проблемы происхождения жизни, — принадлежит немецкому биофизику Гюнтеру Вахтерхойзеру («Philosophical Transactions of the Royal Society, B, Biological Science», 2006, 361, 1787—1806, doi: 10.1098/rstb.2006.1904, пересказ одной из предыдущих его статей в заметке — «Гидротермальные источники — колыбель жизни на Земле?»). Вахтерхойзер обосновал теоретически и проверил экспериментально многие химические реакции, которые происходят в условиях, существующих вблизи «черных курильщиков» и древних континентальных горячих источников, — при температурах 50—150ОС и высоком давлении. Основной источник восстановительных эквивалентов (то есть протонов, принимающих на себя электроны, которые необходимо перенести) — реакция сероводорода с сульфидом железа: H2S + FeS → FeS2 + 2 [H]. Сульфид железа превращается в пирит, атомы водорода остаются адсорбированными на его поверхности. С помощью этих атомов водорода на поверхности сульфида железа может происходить фиксация азота: N2 + 3 H2S + 3FeS 2 → NH3 + 3 FeS2, восстановление CO2 до метилмеркаптана: CO2 + 4H2S + 3FeS → CH3SH + 3 FeS2 + 2H2O, восстановительное аминирование альфа-кетокислот: R-CO-COOH + NH3 + FeS + H2S → R-CHNH2-COOH + FeS2 + H2O. В присутствии сульфида никеля, также характерного для геотермальных источников, разнообразие химических продуктов сильно возрастает — CO2 и СО превращаются в уксусную, пировиноградную и другие органические кислоты, а также в тиометилацетат CH-CO-S-CH. Последний, реагируя с фосфорной кислотой, дает ацетилфосфат — высокоэнергетическое вещество, способное фосфорилировать органические молекулы, в том числе превращать АДФ в АТФ. Отрицательно заряженные органические кислоты остаются адсорбированными на поверхности сульфидов и могут накапливаться в больших концентрациях. Там же происходят более сложные химические реакции, например пептидный цикл глицина, в котором образуются производные мочевины, гидантоины и пуриновые азотистые основания.
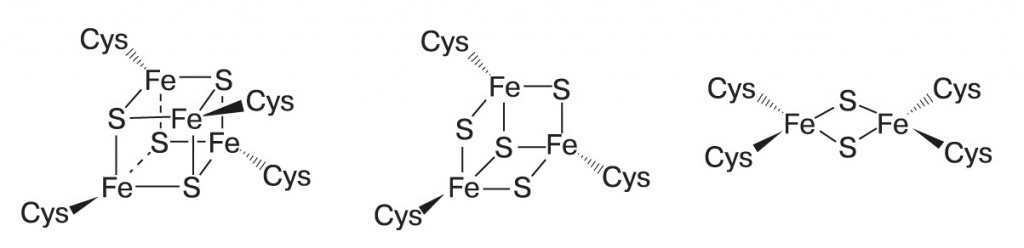
В целом в условиях «черного курильщика» возможен синтез большого разнообразия органики, едва ли не больше, чем в опытах Миллера. Дополнительный аргумент в пользу такого сценария — в ферментах современных клеток содержатся железосерные кластеры, фактически наночастицы пирита. Они переносят водород и участвуют в разнообразных окислительно-восстановительных реакциях. Особо сложный железосерный кластер находится в активном центре фермента нитрогеназы, который восстанавливает атмосферный азот до аммиака.
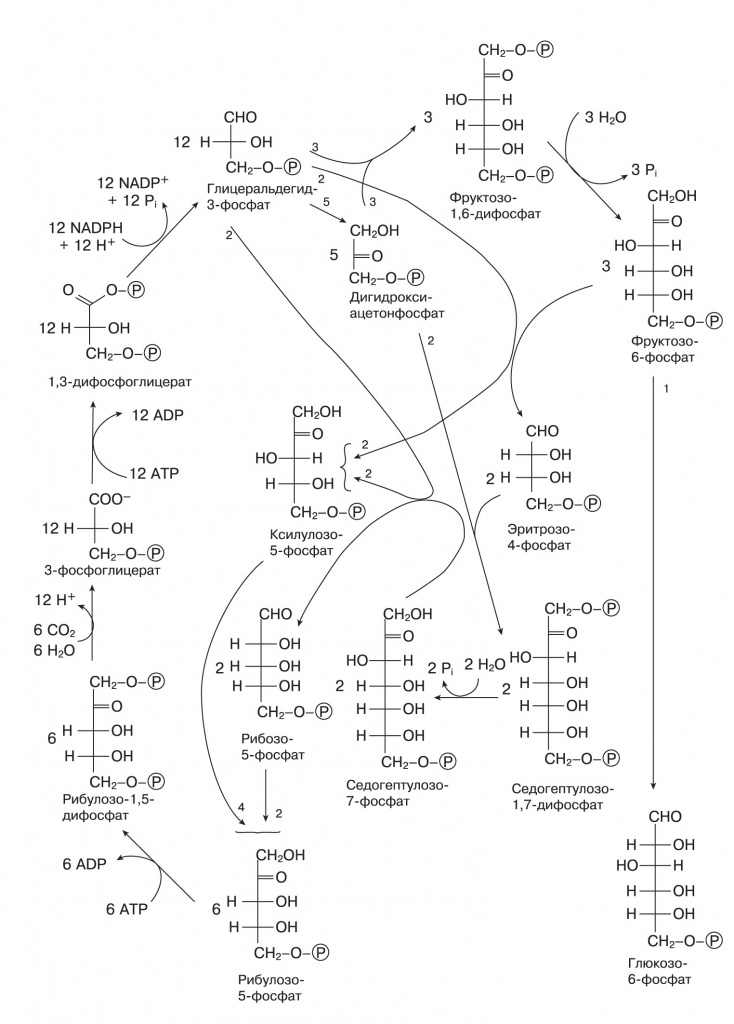
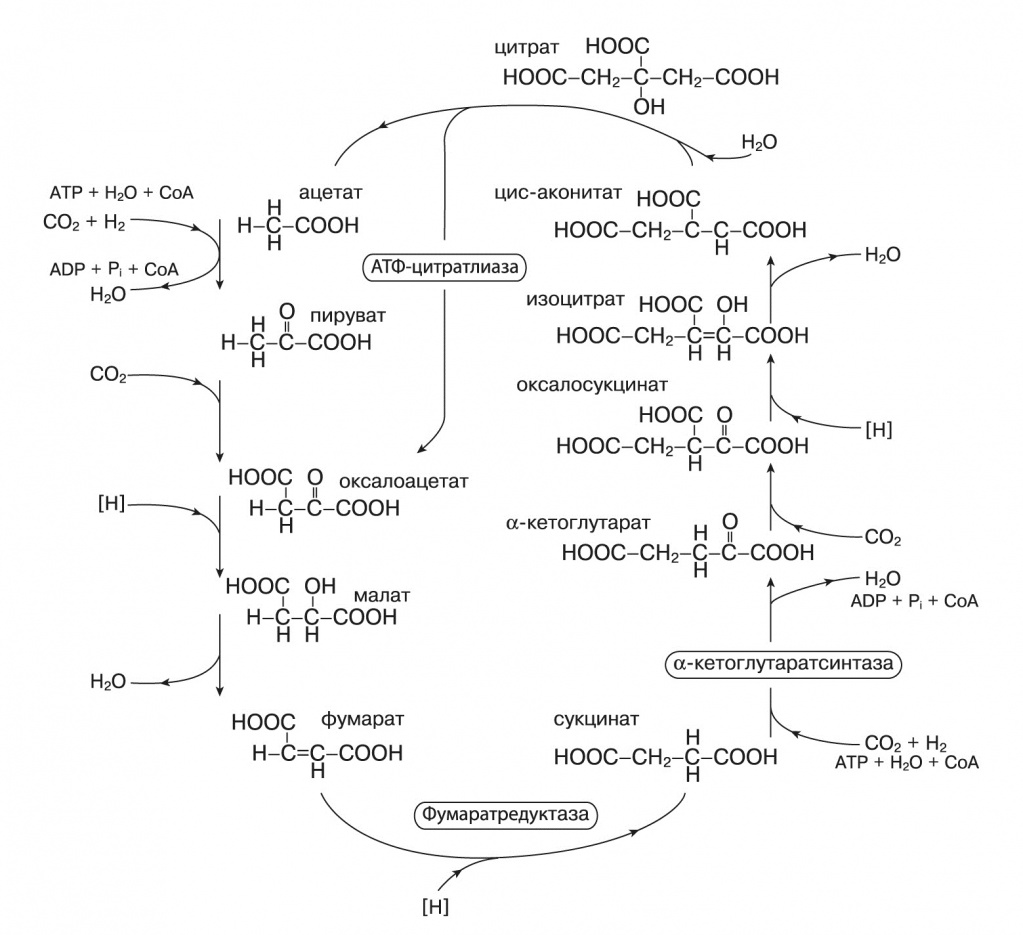
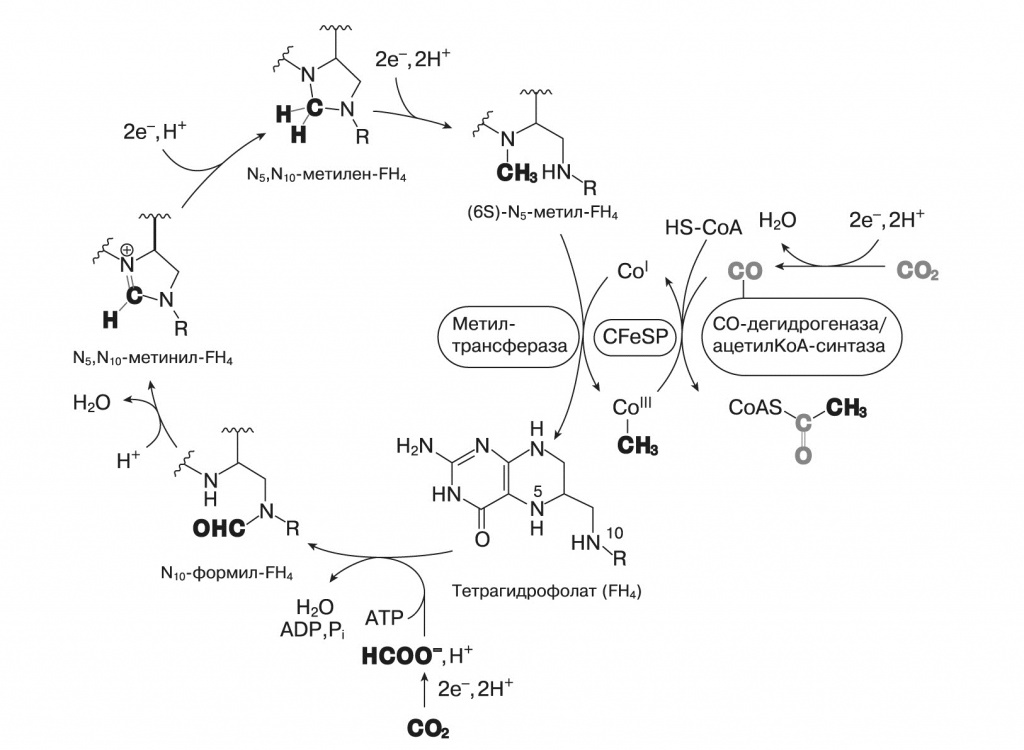
Другой сценарий абиогенного синтеза органики на геотермальных источниках — теорию «цинкового мира» — предложил Армен Мулкиджанян, о работах которого мы писали в предыдущей статье («Biology Direct», 2009, 4, 26, doi: 10.1186/1745-6150-4-26, Mulkidjanian, Galperin, «Biology Direct», 2009, 4, 27, doi: 10.1186/1745-6150-4-27). Он исходил из того, что сульфиды цинка и марганца способны к фотохимическому восстановлению разных веществ. Они, так же, как упомянутый в статье «Проблема хиральной чистоты» оксид титана TiO2, — полупроводники с широкой запрещенной зоной. Их кристаллы поглощают ближний ультрафиолет, и возбужденный электрон может оказаться в «потенциальной яме» на поверхности кристалла. В водной среде эти кристаллы восстанавливают CO2 до муравьиной кислоты и дикарбоновых кислот. Сульфид цинка оказывается самым эффективным восстановителем — с квантовым выходом до 80%. При этом на кристалле накапливается положительный заряд. Если нет подходящих восстановителей, то происходит фотокоррозия сульфида цинка с выходом ионов цинка в раствор и образованием молекулярной серы: CO2+ZnS+H2O → (HCOO) 2Zn+Zn(OH)2+S. Подобно сульфидам железа сульфид цинка на свету может восстанавливать азот до аммиака: N2 + ZnS + H2O → NH3 + Zn(OH)2 + S, который затем реагирует с муравьиной кислотой, давая формамид — ключевой промежуточный продукт для синтеза азотистых оснований. Восстановительное аминирование кетокислот в аминокислоты тоже хорошо катализируется сульфидом цинка при освещении. Абиогенный фотосинтез на сульфиде цинка обладает еще некоторыми интересными свойствами. В роли восстановителя, предохраняющего ZnS от фотокоррозии, как оказалось, могут выступать восстановленные формы фосфора — фосфиты и гипофосфиты. В отличие от фосфатов, они хорошо растворимы в воде. В присутствии фосфитов ZnS проводит фотовосстановление CO2, сопряженное с окислением фосфита до фосфата. Фосфаты остаются адсорбированными на поверхности кристаллов, и это возможное объяснение высокой концентрации фосфатов в живых клетках. В некоторых условиях фотоокисление фосфита до фосфата на ZnS сопровождается фосфорилированием разных органических молекул и, возможно, полимеризацией нуклеозидов (сахар плюс азотистое основание) в полинуклеотиды. Сульфид цинка хорошо адсорбирует нуклеиновые кислоты, так как шаг положительно заряженных ионов на его поверхности соответствует шагу фосфатов РНК и ДНК. Кроме того, сульфид цинка способен принимать фотовозбуждение с нуклеотидов, их полимеров, полипептидов и других молекул. С одной стороны, это защищает полимеры от УФ-расщепления, с другой стороны, накопление полимеров на поверхности минерала позволяет собирать больше света и ускоряет фотосинтез в этом месте — нуклеиновые кислоты работают подобно вспомогательным пигментам. Теперь вернемся к восстановлению молекул углекислого газа. Подобно тому как минеральный состав цитоплазмы несет информацию о среде обитания самых первых клеток, современные пути восстановления CO2 живыми организмами могут воспроизводить какие-то древнейшие реакции, происходившие в неживых системах. Таких путей в современных клетках известно три. Первый — цикл Кальвина, работающий в растениях и большинстве фотосинтезирующих и хемосинтезирующих бактерий. Когда школьникам говорят, что «растения поглощают углекислый газ и синтезируют глюкозу», речь идет именно о цикле Кальвина, но это сильно упрощенная правда (см. схему на следующей странице). Строго говоря, в цикле Кальвина синтезируется трехуглеродный фосфоглицериновый альдегид, а затем из него в несколько этапов получается глюкоза. Второй — восстановительный цикл Кребса, работающий у некоторых анаэробных фотосинтезирующих бактерий. Выпускникам биологических факультетов хорошо известен обычный цикл Кребса, он же цитратный цикл или цикл трикарбоновых кислот, в котором двух- и трехуглеродные органические молекулы, образующиеся при распаде более крупных соединений, окисляются до CO2. Высвобожденные при этом протоны участвуют в синтезе АТФ, энергетической валюты клетки. Восстановительный цикл Кребса «вращается» в обратную сторону: поглощаются молекулы CO2 и протоны на носителе, затрачивается энергия АТФ, образуется четырехуглеродная щавелевоуксусная кислота (оксалоацетат). Заметим, что протоны переносит не кофермент NADH, как в обычном цикле Кребса, а ферредоксин — железосерный белок с высоким восстановительным потенциалом. Третий — восстановительный ацетил-КоА-путь, который имеется у некоторых хемосинтезирующих бактерий и архей. Кофермент А, или КоА, участвует во многих важных биохимических процессах (в том числе и в цикле Кребса, и в цикле Кальвина). Его задача — переносить остатки органических кислот на другие молекулы, например, если с коферментом связан ацетат, это соединение и называют «ацетил-КоА». Восстановительный ацетил-КоА-путь включает в себя параллельное восстановление двух молекул CO2: одна окисляется до СО, другая — до связанной с коферментом метильной группы. Потом они соединяются и переносятся на кофермент А. Возможная роль этой реакции в предбиогенной химии рассмотрена в статье Уильяма Мартина и Майкла Расселла («Philosophical Transactions of the Royal Society, B, Biological Science», 2007, 362, 1887—1925, doi: 10.1098/rstb.2006.1881). Попробуем оценить возможность протекания этих реакций без ферментов, с участием минеральных катализаторов.
Если посмотреть на состав ферментов, катализирующих эти реакции, то бросается в глаза единообразие каталитических металлов в активных центрах. Все реакции восстановительного цикла Кребса катализируются атомами железа, кроме одной, где участвует марганец. В цикле Кальвина в качестве катализаторов используются ионы магния и иногда цинка, так что для любого из трех путей можно допустить, что он катализируется поверхностями одного-двух минералов. На первый взгляд, хороший претендент на роль предбиологического пути восстановления CO2 и предшественника биохимии — восстановительный цикл Кребса. Он, как и его более привычный окислительный аналог, находится в центре всего метаболизма. Из его промежуточных продуктов начинаются все основные пути синтеза — аминокислот, липидов, сахаров, пирролов, пиримидиновых азотистых оснований («Proceedings of the National Academy of Sciences USA», 2000, 97, 14, doi: 10.1073/ pnas.110153997). Этот цикл — автокаталитический, то есть может производить собственные промежуточные продукты и повышать производительность. Однако есть и возражения, подробно рассмотренные в статье Лесли Оргела («PLoS Biology», 2008, 6, doi: 10.1371/journal.pbio.0060018), и главное из них — проблемы со специфичностью минерального катализа. Если у нас есть минерал, катализирующий восстановление альфа-кетокислот до гидроксикислот, например оксалоацетата до малата, то он должен также восстанавливать пируват до молочной кислоты и альфа-кетоглутарат до альфа-гидроксиглутарата, которые уже не входят в этот цикл реакций. Аналогичным образом минеральный катализатор распада цитрата, скорее всего, будет расщеплять и другие кислоты этого цикла. Цикл Кальвина выглядит очень сложным. Однако в нем есть лишь один шаг включения CO2 в органику и один шаг восстановления (от рибулозо-1,5-дифосфата до глицеральдегид-3-фосфата), тогда как в восстановительном цикле Кребса — четыре включения CO2 в разные вещества и четыре шага восстановления. Все остальные реакции цикла Кальвина — просто перестройки сахаров, они полностью аналогичны реакции Бутлерова. Следовательно, для их протекания может быть достаточно одного минерального катализатора, специфично адсорбирующего рибулозодифосфат или просто рибулозу и направляющего таким образом реакции к одному продукту. С другой стороны, цикл Кальвина далек от большинства биохимических путей, он соединяется с ними только через сахара и цикл Кребса. Но для синтеза нуклеотидов и РНК нужны именно сахара, и у некоторых архебактерий известен вариант цикла Кальвина, который начинается не с рибулозодифосфата, а с остатка рибозы в составе аденинового нуклеотида. Восстановительный ацетил-КоА-путь несложен и дает на выходе ацетил- КоА, универсальный промежуточный метаболит, но требует разнообразных катализаторов: помимо ионов металлов (железо, никель, кобальт, молибден и вольфрам), для него нужны сложные органические коферменты — тетрагидрометаноптерин либо тетрагидрофолиевая кислота. Кроме того, он не является автокаталитическим и не может наращивать собственную продуктивность. Итак, ни один из трех современных путей фиксации CO2 нельзя прямо представить в роли предбиологического механизма синтеза органики. Возможно, однако, что эти пути выделились путем упорядочения и упрощения более сложной сети реакций, которая как-то утилизировала и возвращала в автокаталитический цикл продукты побочных реакций (в случае восстановительного цикла Кребса) или давала неизвестные ныне связи синтеза сахаров с другими метаболическими путями для цикла Кальвина. На сегодня экспериментально удалось только провести часть реакций восстановительного цикла Кребса на суспензии сульфида цинка. Теория «цинкового мира» предсказывает, что цитоплазма клеток, РНК-структуры и белки должны быть обогащены ионами цинка. Как мы видели в предыдущем номере, цинк по содержанию в цитоплазме сравним с железом и превосходит все прочие переходные металлы. В структурах РНК железо совершенно отсутствует, а цинк встречается чаще других переходных металлов. За ним следуют марганец, кобальт и вольфрам. Многие рибозимы (молекулы РНК, обладающие каталитической активностью подобно ферментам-белкам) активны только в присутствии ионов металлов. Среди таких металлов самые распространенные — магний, цинк и марганец, а железо никогда не встречается. Цинком также обогащены самые древние белки и ферменты с древними функциями. Из 49 универсальных белковых третичных структур (таких, которые присутствовали во всех прочитанных на 2008 год геномах), 37 содержат цинк, 19 — марганец и только 3 — железо. При этом цинк не обязательно нужен для каталитической активности, часто он просто стабилизирует трехмерную структуру. Одна из таких древних структур — ДНК-РНК-связывающий домен под названием «цинковый палец», где атом цинка связан двумя остатками цистеина и двумя — гистидина, очень часто встречается, например, в белках — факторах транскрипции. Среди активных центров ферментов цинк и марганец преобладают в лиазах, трансферазах и гидролазах, тогда как железо и медь, в том числе похожие на пирит железосерные кластеры, — в более эволюционно молодых окислительно-восстановительных ферментах, медь — практически только в ферментах, работающих с молекулярным кислородом. Таким образом, можно сказать, что содержание металлов в клетках подтверждает теорию «цинкового мира», а не «железосерного мира». В пользу цинкового мира говорит еще то обстоятельство, что ионы железа эффективно гидролизуют РНК, связываясь с гидроксильными группами рибозы. Вахтерхойзер, чтобы обойти эту сложность, говорит, что первые нуклеиновые кислоты содержали вместо рибозы четырехуглеродные сахара, например эритрозу. Такие нуклеиновые кислоты были получены искусственно, они устойчивы к ионам железа, щелочам и высокой температуре и могут комплементарно соединяться с классическими РНК, но в таком случае непонятно, почему они сменились более уязвимыми нуклеиновыми кислотами с рибозой. В целом теория «цинкового мира» находит больше подтверждений, однако полностью отвергать роль химических реакций на поверхности пирита нельзя. В конце концов, зоны сульфидов железа и сульфидов цинка соседствуют в одних и тех же «черных курильщиках». Вещества, синтезируемые на сульфиде железа, постепенно смываются и переносятся с током воды и пара в зону сульфида цинка, где могут включаться в происходящие там под действием света процессы. Одним из важных для будущей биохимии веществ мог быть тиометилацетат — простой органический аналог ацетилкофермента А, способный легко переносить ацетильную группу на другие органические молекулы.
ТегиПохожее
|
| Главная ≫ Инфотека ≫ Химия ≫ Пути восстановления углекислого газа / Биогенез // Михаил Никитин |
|
[time: 8 ms; queries: 8]
1 Мар 2026 08:15:31 GMT+3 |


 Химики показали, что в гидротермальных источниках при температуре свыше 80 градусов может происходить абиогенный синтез органических веществ, в частности аминокислот, из угарного газа, цианистого водорода и других неорганических соединений. Это открытие — важный аргумент в пользу гипотезы, согласно которой жизнь на Земле зародилась в горячих вулканических источниках.
Химики показали, что в гидротермальных источниках при температуре свыше 80 градусов может происходить абиогенный синтез органических веществ, в частности аминокислот, из угарного газа, цианистого водорода и других неорганических соединений. Это открытие — важный аргумент в пользу гипотезы, согласно которой жизнь на Земле зародилась в горячих вулканических источниках. Эта книга предназначена для широкого круга читателей, желающих узнать больше об окружающем нас мире и о самих себе. Автор, известный ученый и популяризатор науки, с необычайной ясностью и глубиной объясняет устройство Вселенной, тайны квантового мира и генетики, эволюцию жизни и показывает важность математики для познания всей природы и человеческого разума в частности.
Эта книга предназначена для широкого круга читателей, желающих узнать больше об окружающем нас мире и о самих себе. Автор, известный ученый и популяризатор науки, с необычайной ясностью и глубиной объясняет устройство Вселенной, тайны квантового мира и генетики, эволюцию жизни и показывает важность математики для познания всей природы и человеческого разума в частности.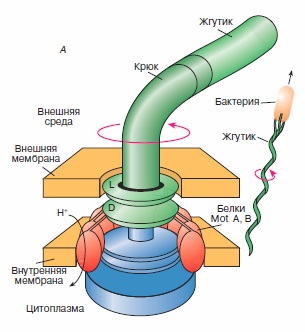 Рассмотрены строение и механизмы действия протонной АТРсинтазы и флагеллярного мотора - молекулярных моторов живой клетки, выполняющих химическую и механическую работу, связанную с их вращательным движением, строение и механизмы работы миозина и кинезина - механохимических белков, ответственных за сократительную активность и внутриклеточный транспорт органелл в клетке.
Рассмотрены строение и механизмы действия протонной АТРсинтазы и флагеллярного мотора - молекулярных моторов живой клетки, выполняющих химическую и механическую работу, связанную с их вращательным движением, строение и механизмы работы миозина и кинезина - механохимических белков, ответственных за сократительную активность и внутриклеточный транспорт органелл в клетке.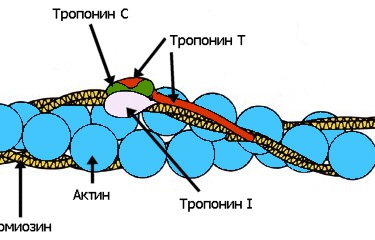 Почти всякая незыблемая общепринятая теория, которую с проклятьями зубрят школьники и которую устало и одинаково рассказывают учителя и даже профессора ВУЗов, при внимательном рассмотрении оказывается отнюдь не однозначной, захватывающей и полной загадок. К теории мышечного сокращения вышесказанное относится в полной мере. В общих чертах она была разработана еще в 50-х годах прошлого века, и классический рисунок с актиновыми и миозиновыми нитями до сих пор кочует из учебника в учебник. Однако реальная картина сокращения мышцы куда запутаннее, интереснее и непонятнее, со множеством подробностей и неожиданных действующих лиц и со сложными ролями, которые исполняют эти лица.
Почти всякая незыблемая общепринятая теория, которую с проклятьями зубрят школьники и которую устало и одинаково рассказывают учителя и даже профессора ВУЗов, при внимательном рассмотрении оказывается отнюдь не однозначной, захватывающей и полной загадок. К теории мышечного сокращения вышесказанное относится в полной мере. В общих чертах она была разработана еще в 50-х годах прошлого века, и классический рисунок с актиновыми и миозиновыми нитями до сих пор кочует из учебника в учебник. Однако реальная картина сокращения мышцы куда запутаннее, интереснее и непонятнее, со множеством подробностей и неожиданных действующих лиц и со сложными ролями, которые исполняют эти лица. Запах корицы и яблок — бабушкин пирог, запах хвои и мандаринов — Новый год, сладкий дурман черемухи — весна… Каждый человек сможет добавить к этому списку длинный ряд своих собственных ассоциаций. Многообразие растительных ароматов, созданных природой, кажется неисчерпаемым, многие из них абсолютно уникальны. Для обозначения таких веществ, которые не принимают непосредственного участия в росте, развитии и репродукции отдельных клеток, более 200 лет назад был предложен термин «вторичные метаболиты». Несмотря на несколько неуважительное название, вещества эти выполняют важную роль в жизни растения в целом, участвуют во взаимодействии растений друг с другом и с окружающей средой. К настоящему моменту идентифицировано более 100000 таких веществ, многие из которых являются легколетучими, и люди воспринимают их как запах растения. В этой лекции я постараюсь рассказать о некоторых особенностях пахучих растений, немного о том, как изучают биосинтез летучих вторичных метаболитов, а также о перспективах применения этих знаний на практике…
Запах корицы и яблок — бабушкин пирог, запах хвои и мандаринов — Новый год, сладкий дурман черемухи — весна… Каждый человек сможет добавить к этому списку длинный ряд своих собственных ассоциаций. Многообразие растительных ароматов, созданных природой, кажется неисчерпаемым, многие из них абсолютно уникальны. Для обозначения таких веществ, которые не принимают непосредственного участия в росте, развитии и репродукции отдельных клеток, более 200 лет назад был предложен термин «вторичные метаболиты». Несмотря на несколько неуважительное название, вещества эти выполняют важную роль в жизни растения в целом, участвуют во взаимодействии растений друг с другом и с окружающей средой. К настоящему моменту идентифицировано более 100000 таких веществ, многие из которых являются легколетучими, и люди воспринимают их как запах растения. В этой лекции я постараюсь рассказать о некоторых особенностях пахучих растений, немного о том, как изучают биосинтез летучих вторичных метаболитов, а также о перспективах применения этих знаний на практике…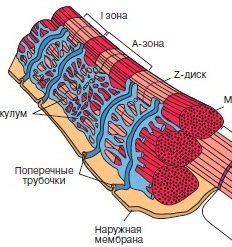 В основе сокращения мышц лежит взаимное перемещение двух систем нитей, образованных актином и миозином. АТФ гидролизуется в активном центре, расположенном в головках миозина. Гидролиз сопровождается изменением ориентации головок миозина и перемещением нитей актина. Регуляция сокращения обеспечивается специальными Са-связывающими белками, расположенными на нитях актина или миозина.
В основе сокращения мышц лежит взаимное перемещение двух систем нитей, образованных актином и миозином. АТФ гидролизуется в активном центре, расположенном в головках миозина. Гидролиз сопровождается изменением ориентации головок миозина и перемещением нитей актина. Регуляция сокращения обеспечивается специальными Са-связывающими белками, расположенными на нитях актина или миозина. Какого цвета могут быть внеземные растения? С научной точки зрения это отнюдь не праздный вопрос, так как цвет поверхности планеты может указать нам, есть ли на ней жизнь, а точнее — живые организмы, усваивающие энергию света своей звезды путем фотосинтеза.
Какого цвета могут быть внеземные растения? С научной точки зрения это отнюдь не праздный вопрос, так как цвет поверхности планеты может указать нам, есть ли на ней жизнь, а точнее — живые организмы, усваивающие энергию света своей звезды путем фотосинтеза. Лекции доктора физико-математических наук, ведущего научного сотрудника сектора математической физики Физического Института им. П.Н. Лебедева РАН, Москва; Directeur de Recherche au CNRS (CNRS — Национальный центр научных исследований) Universite Paris-Sud, Орсэ, Франция Сергея Нечаева, прочитанной 11 апреля 2012 года в рамках проекта «Публичные лекции "Полит.ру"»
Лекции доктора физико-математических наук, ведущего научного сотрудника сектора математической физики Физического Института им. П.Н. Лебедева РАН, Москва; Directeur de Recherche au CNRS (CNRS — Национальный центр научных исследований) Universite Paris-Sud, Орсэ, Франция Сергея Нечаева, прочитанной 11 апреля 2012 года в рамках проекта «Публичные лекции "Полит.ру"»